barva indikátoru fenolftaleinu v základním roztoku je:(a) žlutá (B)Zelená (C) Růžová (D) Oranžová
Tip: fenolftalein je slabá kyselina, a tak uvolňuje ionty $ {H^+} $ v roztoku. Anion se tedy tvoří barevně a označuje koncový bod. Přidání báze do fenolftaleinu způsobí posun rovnováhy směrem k kyselému médiu a uvolnění více iontů $ {H^+}$.
kompletní krok za krokem řešení:
– fenolftalein je syntetický indikátor s molekulárním vzorcem ${C_{20}}{H_{14}}{O_4}$. Patří do třídy barviv ftaleinu a nejčastěji se používá jako indikátor při acidobazických titracích. Od přírody má velmi nízkou rozpustnost ve vodě, a proto je pro použití v experimentech rozpuštěn v alkoholu.
jeho struktura je:
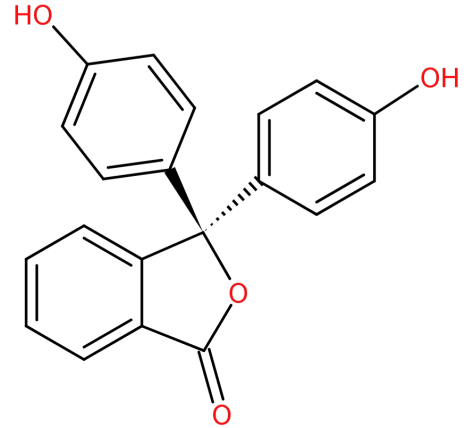
-vzniká kondenzací anhydridu ftalátu se dvěma ekvivalenty fenolu za kyselých podmínek.
– je to slabá kyselina, a proto má schopnost ztratit ionty $ {H^+} $ v roztoku. Před ztrátou iontu ${H^ + }$ je molekula fenolftaleinu bezbarvá, ale po ztrátě iontu $ {H^+} $ tvoří fenolftaleinový ion, který má růžovou barvu.
podle le-Chatelierova principu, pokud k fenolftaleinu přidáme bázi, rovnováha se posune směrem k kyselému médiu, což vede k uvolnění více iontů $ {H^+}$. Tím se roztok změní z bezbarvého na růžový.
proto můžeme říci, že fenolftalein zůstává bezbarvý v kyselých a neutrálních roztocích a v bazických roztocích zbarví růžově. Zůstává bezbarvý až do pH 8.5, zatímco nad tím se změní na růžovou až tmavě červenou barvu.
– v kapalném stavu je bezbarvý, ale pokud je nalezen v pevné krystalické formě, fenolftalein je nažloutlý bílý až světle oranžový nebo jemně bílý krystalický prášek.
– fenolftalein je široce používán jako indikátor pH a laboratorní činidlo. Používá se také v acidobazických titracích jako indikátor, léčivě jako projímadlo a také v Kastle-Mayerově testu. Spolu s methylovou červenou, thymol modrou a bromthymol modrou může také působit jako součást univerzálního indikátoru.
takže správná volba bude: (C) Růžová.
Poznámka: Může přijmout až 4 různé stavy ve vodných roztocích v důsledku změn pH. Když jsou podmínky silně kyselé, existuje v protonované formě ($H{\ln ^ + }$), která má oranžové zbarvení. Pokud jsou podmínky mezi silně kyselými a mírně zásaditými, existuje ve formě laktonu (Hln), který je bezbarvý. Za základních podmínek existuje jako dvojitě deprotonovaná fenolátová forma (${\ln ^{2 -}}$), která je bezbarvá a za silně základních podmínek tvoří $\ln {(OH)^{3 -}} $ formu, která je bezbarvá.
Leave a Reply