principy kapalinové chromatografie
bez ohledu na interakce, které jsou využívány, se chromatografie v kapalinových sloupcích provádí v šesti krocích:
- kolona ekvilibrace
- vzorek loading
- mytí
- eluce
- závěrečné mytí kolony
- regenerace kolony
kolona Ekvilibrace
většina protokolů kapalinové chromatografie začíná krokem ekvilibrace pryskyřice. Pufr, který je kompatibilní s proteinem zájmu a pryskyřice volby se vede přes kolonu. Běžnou praxí je vyrovnání kolony s 5 až 10 objemy sloupců (CVs) ekvilibračního pufru.
například vazba proteinů na hydrofobní interakční pryskyřice je nejúčinnější při vysoké iontové pevnosti. Před aplikací vzorku je proto pryskyřice vyrovnána v pufru s vysokou iontovou pevností.
vlastnosti sledovaného proteinu jsou také zvažovány při výběru ekvilibračního pufru, protože pufrové faktory, jako je iontová síla, jsou omezeny stabilitou proteinu; obvykle by se člověk vyhnul podmínkám ekvilibračního pufru, které by denaturovaly sledovaný protein nebo mu bránily v interakci se stacionární fází.
vzorek Loading
po ekvilibraci se vzorek načte na kolonu. Vzorek se obecně naloží do pufru se stejným složením jako ekvilibrační pufr, aby se maximalizovala interakce proteinu se stacionární fází.
vzorek lze načíst ručně nebo pomocí vzorkovacího čerpadla. Některé typy chromatografie omezují objem vzorku, který lze načíst do sloupce. Dalším důležitým hlediskem zatížení vzorku je, že většina pryskyřic má konečnou kapacitu vázat protein; přetížení kolony použitím příliš velkého množství vzorku může nepříznivě ovlivnit separaci.
promývání kolony
jakmile jsou proteiny imobilizovány ve stacionární fázi, proteiny, které interagují pouze slabě nebo nespecificky s pryskyřicí, se odstraní promytím kolony několika objemy kolony promývacího pufru. Tento promývací pufr může mít stejné složení jako ekvilibrační pufr nebo může obsahovat složky, které narušují slabé specifické interakce.
například imobilizovaná kovová afinitní chromatografie (IMAC) eluuje proteiny navázané na pryskyřici s vysokou koncentrací immidazolu. Běžnou praxí je použití promývacího pufru, který obsahuje střední koncentraci immidazolu k odstranění kontaminujících proteinů, které jsou na pryskyřici vázány pouze slabě.
Kolona se promyje, dokud není v eluátu detekován žádný protein. Při použití chromatografického systému s UV detektorem se kolona promyje, dokud se absorpční odečet 280 nm nevrátí k základní linii.
eluce vzorku
po vymytí všech nespecificky a slabě interagujících proteinů z pryskyřice se proteiny, které silně interagují s pryskyřicí, eluují z kolony změnou složení pufru, který prochází přes pryskyřici.
v iontoměničové chromatografii se proteiny eluují pufry s vysokou iontovou pevností nebo se změnou pH, aby narušily elektrostatické interakce, které imobilizovaly požadovaný protein. Proteiny navázané na hydrofobní interakční pryskyřici se naopak eluují snížením iontové síly pufru. V afinitní chromatografii, proteiny jsou běžně eluovány z kolony zavedením konkurenčního ligandu nebo štěpením afinitní značky a mohou být také eluovány pomocí pufrů s vysokým obsahem soli nebo změnou pH. Jiné eluční protokoly mohou zahrnovat míchání rozpouštědel s různou polaritou pro vyladění rozpustnosti každé složky v mobilní fázi.
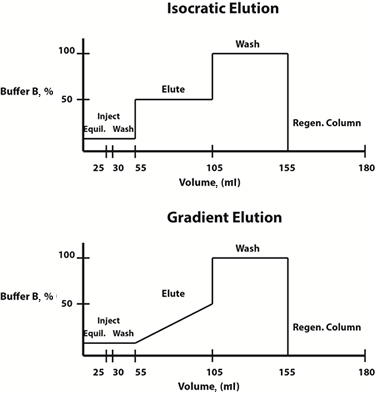
obr. 3: Příklad diagramů složení pufru pro izokratické (horní) a gradientní (spodní) eluční protokoly.
eluční podmínky mohou být změněny buď lineárním gradientem, nebo postupným způsobem. Často se volí gradientní eluční protokol, ve kterém se složení mobilní fáze mění lineárně v průběhu času, aby se určil eluční profil a koncentrace eluračního pufru, při které je sledovaný protein uvolněn z pryskyřice. Jakmile je tato koncentrace stanovena, pro úsporu času lze pro budoucí čištění navrhnout postupný izokratický eluční protokol, ve kterém je složení mobilní fáze konstantní v každém kroku.
Poznámka: Chromatografie s vyloučením velikosti nevyžaduje změny pufru, protože nezávisí na specifických interakcích mezi mobilní fází a stacionární fází. Neexistují žádné skutečné promývací a eluční kroky, protože SEC se spoléhá pouze na skutečnost, že velké molekuly jsou retardovány porézními kuličkami, zatímco malé molekuly procházejí pryskyřicí s minimální interakcí pryskyřice.
závěrečné promývání kolony
po eluování sledovaného proteinu z pryskyřice se všechny proteiny, které zůstávají navázány na pryskyřici, eluují zvýšením pevnosti elučního pufru. Tento krok umožňuje sloupce, které mají být znovu použity pro budoucí separace.
regenerace kolony
po stripování zbývajících sloučenin vázaných na médium se pak kolona buď nasytí ekvilibračním pufrem pro následné opětovné použití, nebo naplní zásobním pufrem.
Leave a Reply