farven på phenolphthalein-indikatoren i basisk opløsning er:(A) Gul(B) grøn(C) lyserød(D) Orange
tip: Phenolphthalein er en svag syre, og det frigiver derfor ${H^ + }$ ioner i opløsning. Anionen dannes således i farvet og angiver slutpunktet. Tilføjelse af en base til phenolphthalein får ligevægten til at skifte mod det sure medium og frigive flere ${H^ + }$ ioner.
komplet trin for trin løsning:
– Phenolphthalein er en syntetisk indikator med en molekylformel på ${C_{20}}{H_{14}}{O_4}$. Det tilhører phthalein-klassen af farvestoffer og bruges oftest som indikator i syre-base titreringer. Af natur har den meget lav opløselighed i vand, og så til brug i forsøg er det opløst i alkohol.
dens struktur er:
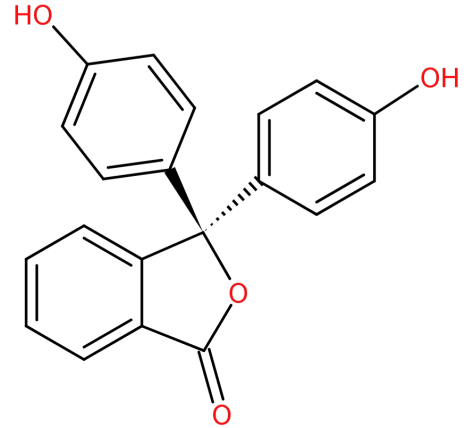
-det dannes ved kondensering af phthalsyreanhydrid med to ækvivalenter af phenol under sure betingelser.
– det er en svag syre og har således evnen til at miste ${H^ + }$ ioner i opløsning. Før du mister ${H^ + }$ ion, er phenolphthaleinmolekylet farveløst, men efter at have mistet ${H^ + }$ ion danner det phenolphthaleinionen, som er lyserød i farven.
ifølge Le-Chateliers princip, hvis vi tilføjer en base til phenolphthalein, vil ligevægten skifte mod surt medium, der fører til frigivelse af flere ${H^ + }$ ioner. Således bliver opløsningen fra farveløs til lyserød.
derfor kan vi sige, at phenolphthalein forbliver farveløs i sure og neutrale opløsninger og bliver lyserød i basale opløsninger. Det forbliver farveløst indtil pH på 8.5, mens den ovenover bliver lyserød til dyb rød i farven.
– i flydende tilstand er det farveløst, men når det findes i fast krystallinsk form phenolphthalein er gullig-hvid til bleg orange eller fint hvidt krystallinsk pulver.
– Phenolphthalein anvendes i vid udstrækning som en pH-indikator og et laboratoriemiddel. Det bruges også i syre-base titreringer som indikator, medicinsk som afføringsmiddel og i Kastle-Mayer test også. Sammen med methylrød, thymolblå og bromothymolblå kan den også fungere som en komponent i universel indikator.
så den rigtige mulighed vil være: (C) Pink.
Bemærk: Det kan vedtage op til 4 forskellige tilstande i vandige opløsninger på grund af pH-ændringerne. Når betingelserne er stærkt sure, findes den i protoneret form ($H{\ln ^ + }$), som har orange farvning. Når betingelserne er mellem stærkt sure og lidt basale, findes den i lactonform (Hln), som er farveløs. Under grundlæggende betingelser eksisterer den som dobbelt deprotoneret phenolform (${\ln ^{2 -}}$), som er farveløs og under stærkt grundlæggende betingelser danner den $\ln {(OH)^{3 – }}$ form, som er farveløs.
Leave a Reply