Væskekromatografiprincipper
uanset de interaktioner, der udnyttes, udføres væskekromatografi i seks trin:
- kolonneækvilibrering
- prøveindlæsning
- vask
- Slutkolonnevask
- Kolonneregenerering
Kolonneækvilibrering
de fleste væskekromatografiprotokoller begynder med et harpiksækvilibreringstrin. En buffer, der er kompatibel med proteinet af interesse og den valgte harpiks, føres over søjlen. En almindelig praksis er at ækvilibrere kolonnen med 5-10 kolonnevolumener (CV ‘ er) af ækvilibreringsbuffer.
for eksempel er binding af proteiner til hydrofobe interaktionsharpikser mest effektiv ved høj ionstyrke. Før prøveanvendelse ækvilibreres harpiksen derfor i en buffer med høj ionstyrke.
egenskaberne af proteinet af interesse overvejes også ved valg af ækvilibreringsbuffer, da bufferfaktorer såsom ionisk styrke er begrænset af proteinstabilitet; typisk ville man undgå ækvilibreringsbufferbetingelser, der ville denaturere proteinet af interesse eller forhindre det i at interagere med den stationære fase.
Prøveindlæsning
efter ækvilibrering indlæses prøven på søjlen. Prøven indlæses generelt i en buffer med den samme sammensætning som ækvilibreringsbufferen for at maksimere proteininteraktion med den stationære fase.
prøve kan indlæses manuelt eller ved hjælp af en prøvepumpe. Nogle typer kromatografi begrænser mængden af prøve, der kan indlæses på søjlen. En anden vigtig overvejelse af prøveindlæsning er, at de fleste harpikser har en endelig kapacitet til at binde protein; overbelastning af en søjle ved at anvende for meget prøve kan påvirke adskillelsen negativt.
Kolonnevask
når proteiner er blevet immobiliseret i den stationære fase, fjernes proteiner, der kun interagerer svagt eller uspecifikt med harpiksen, ved at vaske søjlen med flere kolonnevolumener vaskebuffer. Denne vaskebuffer kan have den samme sammensætning som ækvilibreringsbufferen eller indeholde komponenter, der forstyrrer svage specifikke interaktioner.
for eksempel eluerer immobiliseret metalaffinitetskromatografi (IMAC) proteiner bundet til harpiksen med en høj koncentration af immidasol. En almindelig praksis er at bruge en vaskebuffer, der inkluderer en mellemkoncentration af immidasol for at eliminere forurenende proteiner, der kun er svagt bundet til harpiksen.
søjlen vaskes, indtil der ikke påvises noget protein i eluatet. Ved anvendelse af et kromatografisystem med en UV-detektor vaskes søjlen, indtil 280 nm absorptionsaflæsningen vender tilbage til basislinjen.
Prøveeluering
når alle ikke-specifikt og svagt interagerende proteiner er blevet vasket af harpiksen, elueres proteiner, der interagerer stærkt med harpiksen, fra søjlen ved at ændre sammensætningen af bufferen, der føres over harpiksen.
i ionbytningskromatografi elueres proteiner med buffere med høj ionisk styrke eller med en ændring i pH for at forstyrre de elektrostatiske interaktioner, der immobiliserede proteinet af interesse. Proteiner bundet til en hydrofob interaktionsharpiks elueres omvendt ved at sænke bufferens Ioniske styrke. I affinitetskromatografi elueres proteiner almindeligvis fra søjlen ved introduktion af en konkurrerende ligand eller ved spaltning af affinitetsmærket og kan også elueres ved hjælp af buffere med højt saltindhold eller ændring af pH. Andre elueringsprotokoller kan involvere blanding af opløsningsmidler med forskellig polaritet for at indstille opløseligheden af hver komponent i den mobile fase.
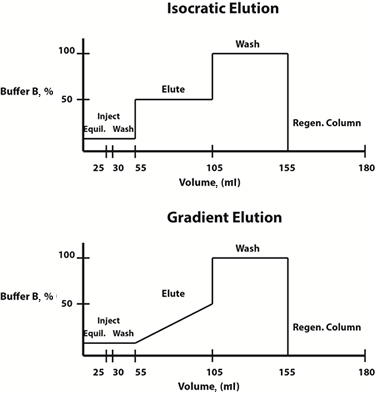
Fig. 3: eksempel buffer sammensætning diagrammer for isokratiske (top) og gradient (bund) eluering protokoller.
Elueringsforholdene kan enten ændres lineært eller trinvist. Ofte vælges en gradient elueringsprotokol, hvor sammensætningen af den mobile fase ændres lineært over tid, til at bestemme elueringsprofilen og elueringsbufferkoncentrationen, ved hvilken proteinet af interesse frigøres fra harpiksen. Når denne koncentration er bestemt, for at spare tid, kan en trinvis isokratisk elueringsprotokol, hvor sammensætningen af den mobile fase er konstant ved hvert trin, designes til fremtidige rensninger.
Bemærk: Størrelse udelukkelse kromatografi kræver ikke bufferændringer, da det ikke afhænger af specifikke interaktioner mellem den mobile fase og den stationære fase. Der er ingen ægte vaske-og elueringstrin, da SEC udelukkende er afhængig af det faktum, at store molekyler forsinkes af porøse perler, mens små molekyler passerer gennem harpiksen med minimal harpiksinteraktion.
Slutkolonnevask
efter at proteinet af interesse er elueret fra harpiksen, elueres eventuelle proteiner, der forbliver bundet til harpiksen, ved at øge styrken af elueringsbufferen. Dette trin gør det muligt at genbruge kolonner til fremtidige separationer.
Søjleregenerering
efter stripning af de resterende forbindelser, der er bundet til mediet, er søjlen derefter enten mættet med ækvilibreringsbuffer til efterfølgende genbrug eller fyldt med en lagringsbuffer.
Leave a Reply