Die Farbe des Phenolphthalein-Indikators in basischer Lösung ist: (A) Gelb (B) Grün (C) Rosa (D) Orange
Hinweis: Phenolphthalein ist eine schwache Säure und setzt daher $ {H ^ + } $ -Ionen in Lösung frei. Das Anion bildet sich somit farbig und zeigt den Endpunkt an. Das Hinzufügen einer Base zu Phenolphthalein bewirkt, dass sich das Gleichgewicht in Richtung des sauren Mediums verschiebt und mehr $ {H ^ + } $ -Ionen freisetzt.
Komplette Schritt-für-Schritt-Lösung:
-Phenolphthalein ist ein synthetischer Indikator mit der Summenformel ${C_{20}}{H_{14}}{O_4}$. Es gehört zur Klasse der Phthaleinfarbstoffe und wird am häufigsten als Indikator bei Säure-Base-Titrationen verwendet. Von Natur aus hat es eine sehr geringe Löslichkeit in Wasser und wird daher zur Verwendung in Experimenten in Alkohol gelöst.
Seine Struktur ist:
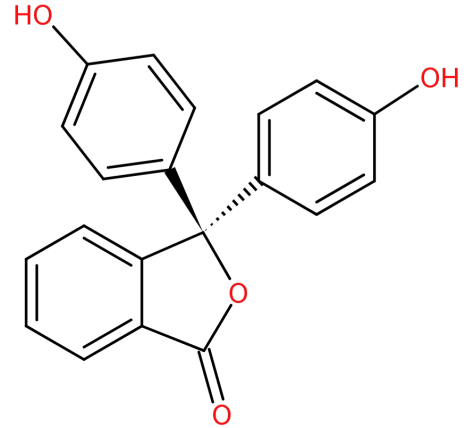
– Es entsteht durch Kondensation von Phthalsäureanhydrid mit zwei Äquivalenten Phenol unter sauren Bedingungen.
– Es ist eine schwache Säure und hat daher die Fähigkeit, $ {H ^ + } $ -Ionen in Lösung zu verlieren. Vor dem Verlust des $ {H ^ + } $ -Ions ist das Phenolphthaleinmolekül farblos, aber nach dem Verlust des $ {H ^ + } $ -Ions bildet es das Phenolphthaleinion, das rosa gefärbt ist.
Nach dem Prinzip von Le-Chatelier verschiebt sich das Gleichgewicht, wenn wir Phenolphthalein eine Base hinzufügen, in Richtung saures Medium, was zur Freisetzung von mehr $ {H ^ + } $ -Ionen führt. Dadurch wird die Lösung von farblos zu rosa.
Daher kann man sagen, dass Phenolphthalein in sauren und neutralen Lösungen farblos bleibt und in basischen Lösungen rosa wird. Es bleibt bis pH 8 farblos.5, während es darüber rosa bis tiefrot wird.
– Im flüssigen Zustand ist es farblos, aber wenn es in fester kristalliner Form gefunden wird, ist Phenolphthalein gelblich-weiß bis blassorange oder feines weißes kristallines Pulver.
-Phenolphthalein wird häufig als pH-Indikator und Labormittel verwendet. Es wird auch in Säure-Base-Titrationen als Indikator, medizinisch als Abführmittel und im Kastle-Mayer-Test verwendet. Zusammen mit Methylrot, Thymolblau und Bromthymolblau kann es auch als Bestandteil eines universellen Indikators wirken.
Die richtige Option ist also: (C) Pink.
Hinweis: Es kann bis zu 4 verschiedene Zustände in wässrigen Lösungen aufgrund der pH-Änderungen annehmen. Wenn die Bedingungen stark sauer sind, existiert es in der protonierten Form ($ H {\ ln ^ + } $), die orange Färbung hat. Wenn die Bedingungen zwischen stark sauer und leicht basisch sind, liegt es in Lactonform (Hln) vor, die farblos ist. Unter basischen Bedingungen liegt es als doppelt deprotonierte Phenolatform (${\ln^{2 – }}$) vor, die farblos ist, und unter stark basischen Bedingungen bildet es die $\ln{(OH)^{3 – }}$-Form, die farblos ist.
Leave a Reply