Prinzipien der Flüssigkeitschromatographie
Unabhängig von den ausgenutzten Wechselwirkungen wird die Flüssigkeitssäulen-Chromatographie in sechs Schritten durchgeführt:
- Säulenäquilibrierung
- Probenbeladung
- Waschen
- Elution
- Abschließendes Säulenwaschen
- Säulenregeneration
Säulenäquilibrierung
Die meisten Flüssigchromatographieprotokolle beginnen mit einem Harzäquilibrierungsschritt. Ein Puffer, der mit dem interessierenden Protein und dem Harz der Wahl kompatibel ist, wird über die Säule geleitet. Eine gängige Praxis ist das Equilibrieren der Säule mit 5-10 Säulenvolumina (CVs) Equilibrierungspuffer.
Beispielsweise ist die Bindung von Proteinen an hydrophobe Interaktionsharze bei hoher Ionenstärke am effizientesten. Vor der Probenapplikation wird das Harz daher in einem Puffer hoher Ionenstärke äquilibriert.
Die Eigenschaften des Proteins von Interesse werden auch bei der Auswahl des Äquilibrierungspuffers berücksichtigt, da Pufferfaktoren wie die Ionenstärke durch die Proteinstabilität begrenzt sind; Typischerweise würde man Äquilibrierungspufferbedingungen vermeiden, die das Protein von Interesse denaturieren oder verhindern würden, dass es mit der stationären Phase interagiert.
Beladung der Probe
Nach dem Äquilibrieren wird die Probe auf die Säule geladen. Die Probe wird im Allgemeinen in einen Puffer mit der gleichen Zusammensetzung wie der Äquilibrierungspuffer geladen, um die Proteininteraktion mit der stationären Phase zu maximieren.
Probe kann manuell oder mit einer Probenpumpe geladen werden. Einige Arten Chromatographie begrenzen das Volumen der Probe, die auf die Spalte geladen werden kann. Eine andere wichtige Probe, die Erwägung lädt, ist, dass die meisten Harze eine begrenzte Kapazität haben, Protein zu binden; das Überladen einer Spalte, indem es zu viel Probe anwendet, kann Trennung nachteilig beeinflussen.
Säulenwäsche
Nach Immobilisierung von Proteinen an der stationären Phase werden Proteine, die nur schwach oder unspezifisch mit dem Harz interagieren, durch Waschen der Säule mit mehreren Säulenvolumina Waschpuffer entfernt. Dieser Waschpuffer kann die gleiche Zusammensetzung wie der Äquilibrierungspuffer aufweisen oder Komponenten enthalten, die schwache spezifische Wechselwirkungen stören.
Beispielsweise eluiert die Immobilized-Metal Affinity Chromatography (IMAC) an das Harz gebundene Proteine mit einer hohen Konzentration an Imidazol. Eine gängige Praxis ist die Verwendung eines Waschpuffers, der eine Zwischenkonzentration von Immidazol enthält, um kontaminierende Proteine zu eliminieren, die nur schwach an das Harz gebunden sind.
Die Säule wird gewaschen, bis im Eluat kein Protein mehr nachgewiesen wird. Bei Verwendung eines Chromatographiesystems mit einem UV-Detektor wird die Säule gewaschen, bis der Absorptionswert von 280 nm wieder auf den Ausgangswert zurückkehrt.
Probenelution
Nachdem alle unspezifisch und schwach wechselwirkenden Proteine vom Harz abgewaschen wurden, werden Proteine, die stark mit dem Harz wechselwirken, durch Veränderung der Zusammensetzung des Puffers, der über das Harz geleitet wird, aus der Säule eluiert.
Bei der Ionenaustauschchromatographie werden Proteine mit Puffern mit hoher Ionenstärke oder mit einer Änderung des pH–Werts eluiert, um die elektrostatischen Wechselwirkungen zu stören, die das interessierende Protein immobilisiert haben. Proteine, die an ein hydrophobes Interaktionsharz gebunden sind, werden umgekehrt eluiert, indem die Ionenstärke des Puffers verringert wird. Bei der Affinitätschromatographie werden Proteine üblicherweise durch Einführung eines konkurrierenden Liganden oder durch Spaltung des Affinitätsmarkens aus der Säule eluiert und können auch unter Verwendung von Hochsalzpuffern oder einer Änderung des pH-Werts eluiert werden. Andere Elutionsprotokolle können das Mischen von Lösungsmitteln unterschiedlicher Polarität beinhalten, um die Löslichkeit jeder Komponente in der mobilen Phase abzustimmen.
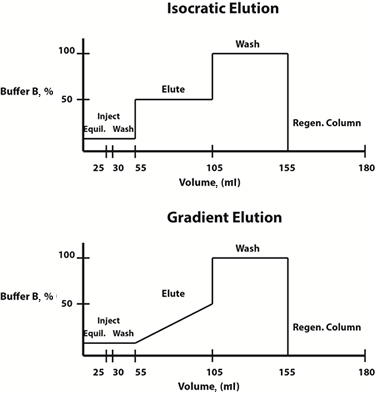
Abb. 3: Beispielhafte Diagramme der Pufferzusammensetzung für isokratische (oben) und Gradienten (unten) Elutionsprotokolle.
Die Elutionsbedingungen können entweder linear gradient oder schrittweise geändert werden. Häufig wird ein Gradientenelutionsprotokoll gewählt, bei dem sich die Zusammensetzung der mobilen Phase linear über die Zeit ändert, um das Elutionsprofil und die Elutionspufferkonzentration zu bestimmen, bei der das interessierende Protein vom Harz befreit wird. Sobald diese Konzentration bestimmt worden ist, um Zeit zu sparen, kann ein schrittweises isokratisches Elutionsprotokoll entworfen werden, in dem die Zusammensetzung der beweglichen Phase an jedem Schritt konstant ist, für zukünftige Reinigungen.
Hinweis: Die Größenausschlusschromatographie erfordert keine Pufferänderungen, da sie nicht von spezifischen Wechselwirkungen zwischen der mobilen Phase und der stationären Phase abhängt. Es gibt keine echten Wasch- und Elutionsschritte, da SEC ausschließlich auf der Tatsache beruht, dass große Moleküle durch poröse Kügelchen verzögert werden, während kleine Moleküle das Harz mit minimaler Harzinteraktion passieren.
Abschließendes Waschen der Säule
Nachdem das interessierende Protein aus dem Harz eluiert wurde, werden alle Proteine, die an das Harz gebunden bleiben, durch Erhöhen der Stärke des Elutionspuffers eluiert. Mit diesem Schritt können Spalten für zukünftige Trennungen wiederverwendet werden.
Säulenregeneration
Nach Strippen der restlichen mediengebundenen Verbindungen wird die Säule dann entweder mit Equilibrierungspuffer zur späteren Wiederverwendung gesättigt oder mit einem Speicherpuffer gefüllt.
Leave a Reply