El color del indicador de fenolftaleína en la solución básica es:(A) Amarillo(B) Verde(C) Rosa(D) Naranja
Pista: La fenolftaleína es un ácido débil y, por lo tanto, libera iones {{H^+} ions en la solución. El anión se forma de color e indica el punto final. La adición de una base a la fenolftaleína hace que el equilibrio se desplace hacia el medio ácido y libere más iones {{H^+} ions.
Solución completa paso a paso:
– La fenolftaleína es un indicador sintético con una fórmula molecular de {{C_{20}} {H_{14}} {O_4}$. Pertenece a la clase de colorantes de ftaleína y se usa con mayor frecuencia como indicador en titulaciones ácido-base. Por naturaleza, tiene muy baja solubilidad en agua y, por lo tanto, para su uso en experimentos, se disuelve en alcohol.
Su estructura es:
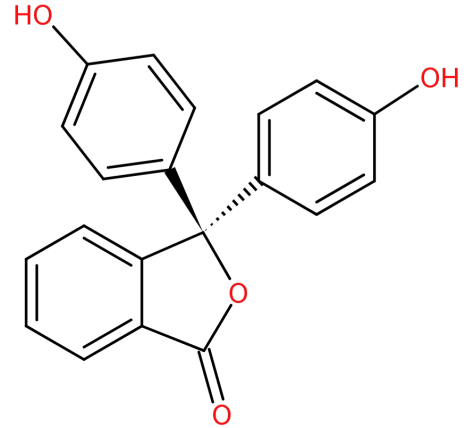
-es formado por la condensación de anhídrido ftálico con dos equivalentes de fenol bajo condiciones ácidas.
– Es un ácido débil y por lo tanto tiene la capacidad de perder iones {{H^+} ions en solución. Antes de perder el ion{H^+} ion, la molécula de fenolftaleína es incolora, pero después de perder el ion{H^+} forms forma el ion de fenolftaleína de color rosa.
De acuerdo con el principio de Le-Chatelier, si agregamos una base a la fenolftaleína, el equilibrio cambiará hacia un medio ácido que conducirá a la liberación de iones más {{H^+} ions. De este modo, la solución pasa de incolora a rosa.
Por lo tanto, podemos decir que la fenolftaleína permanece incolora en soluciones ácidas y neutras y se vuelve rosa en soluciones básicas. Permanece incoloro hasta un pH de 8.5, mientras que por encima de eso se vuelve de color rosa a rojo intenso.
– En estado líquido es incoloro, pero cuando se encuentra en forma cristalina sólida, la fenolftaleína es de color blanco amarillento a naranja pálido o polvo cristalino blanco fino.
– La fenolftaleína es ampliamente utilizada como indicador de pH y agente de laboratorio. También se utiliza en titulaciones ácido-base como indicador, medicinalmente como laxante y en la prueba de Kastle-Mayer también. Junto con el rojo de metilo, el azul de timol y el azul de bromotimol, también puede actuar como un componente del indicador universal.
Por lo tanto, la opción correcta será: (C) Rosa.
Nota: Puede adoptar hasta 4 estados diferentes en soluciones acuosas debido a los cambios de pH. Cuando las condiciones son fuertemente ácidas, existe en forma protonada(H H {\ln^ + }$), que tiene coloración naranja. Cuando las condiciones son entre fuertemente ácidas y ligeramente básicas, existe en forma de lactona (Hln), que es incolora. Bajo condiciones básicas existe como forma de fenolato doblemente desprotonado ({{\ln ^{2 -}}$) que es incolora y bajo condiciones muy básicas forma form\ln {(OH)^{3 -}} form forma incolora.
Leave a Reply