La couleur de l’indicateur de phénolphtaléine en solution basique est: (A) Jaune (B) Vert (C) Rose (D) Orange
Indice: La phénolphtaléine est un acide faible et libère donc des ions{{H^+} in en solution. L’anion se forme ainsi en couleur et indique le point final. L’ajout d’une base à la phénolphtaléine provoque un déplacement de l’équilibre vers le milieu acide et la libération d’ions more{{H^+}$.
Solution complète étape par étape:
– La phénolphtaléine est un indicateur synthétique de formule moléculaire de{{C_{20}}{H_{14}}{O_4}$. Il appartient à la classe des colorants à base de phtaléine et est le plus souvent utilisé comme indicateur dans les titrages acido-basiques. Par nature, il a une très faible solubilité dans l’eau et donc pour une utilisation dans des expériences, il est dissous dans l’alcool.
Sa structure est:
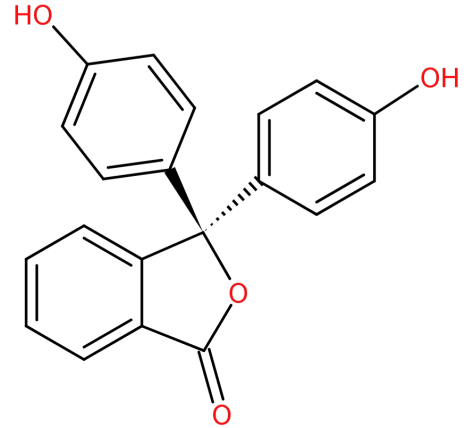
– Il est formé par condensation de l’anhydride phtalique avec deux équivalents de phénol dans des conditions acides.
– C’est un acide faible et a donc la capacité de perdre des ions{{H^+} ions en solution. Avant de perdre l’ion{{H^+}$, la molécule de phénolphtaléine est incolore mais après avoir perdu l’ion{{H^+} forms, elle forme l’ion phénolphtaléine qui est de couleur rose.
Selon le principe de Le-Chatelier, si l’on ajoute une base à la phénolphtaléine, l’équilibre se déplacera vers un milieu acide conduisant à la libération d’ions more{{H^+}$. La solution passe ainsi de l’incolore au rose.
On peut donc dire que la phénolphtaléine reste incolore dans les solutions acides et neutres et devient rose dans les solutions basiques. Il reste incolore jusqu’à un pH de 8.5, alors qu’au-dessus, il devient rose à rouge foncé.
– À l’état liquide, elle est incolore, mais lorsqu’elle se trouve sous forme cristalline solide, la phénolphtaléine est d’un blanc jaunâtre à orange pâle ou d’une fine poudre cristalline blanche.
– La phénolphtaléine est largement utilisée comme indicateur de pH et agent de laboratoire. Il est également utilisé dans les titrages acide-base comme indicateur, en médecine comme laxatif et dans le test de Kastle-Mayer également. Avec le rouge de méthyle, le bleu de thymol et le bleu de bromothymol, il peut également agir comme un composant d’indicateur universel.
Donc, l’option correcte sera: (C) Rose.
Remarque: Il peut adopter jusqu’à 4 états différents dans les solutions aqueuses en raison des changements de pH. Lorsque les conditions sont fortement acides, il existe sous la forme protonée (HH{\ln^+}$), qui a une coloration orange. Lorsque les conditions sont entre fortement acide et légèrement basique, il existe sous forme de lactone (Hln) qui est incolore. Dans les conditions de base, il existe sous forme de phénolate doublement déprotoné ({{\ln^{2-}}$) incolore et sous des conditions fortement basiques, il forme form\ln{(OH)^{3-}} form incolore.
Leave a Reply