Principes de Chromatographie liquide
Quelles que soient les interactions exploitées, la chromatographie sur colonne liquide est réalisée en six étapes:
- Equilibration de la colonne
- Chargement de l’échantillon
- Lavage
- Élution
- Lavage final de la colonne
- Régénération de la colonne
Equilibration de la colonne
La plupart des protocoles de chromatographie liquide commencent par une étape d’équilibration de la résine. Un tampon compatible avec la protéine d’intérêt et la résine de choix est passé sur la colonne. Une pratique courante consiste à équilibrer la colonne avec 5 à 10 volumes de colonne (CVs) de tampon d’équilibration.
Par exemple, la liaison des protéines aux résines d’interaction hydrophobes est la plus efficace à haute résistance ionique. Avant l’application de l’échantillon, la résine est donc équilibrée dans un tampon de haute résistance ionique.
Les propriétés de la protéine d’intérêt sont également prises en compte dans la sélection du tampon d’équilibration, car des facteurs tampons tels que la force ionique sont limités par la stabilité de la protéine; typiquement, on éviterait des conditions de tampon d’équilibration qui dénatureraient la protéine d’intérêt ou l’empêcheraient d’interagir avec la phase stationnaire.
Chargement de l’échantillon
Après l’équilibrage, l’échantillon est chargé sur la colonne. L’échantillon est généralement chargé dans un tampon de même composition que le tampon d’équilibration pour maximiser l’interaction des protéines avec la phase stationnaire.
L’échantillon peut être chargé manuellement ou à l’aide d’une pompe à échantillon. Certains types de chromatographie limitent le volume d’échantillon pouvant être chargé sur la colonne. Une autre considération importante de la charge d’échantillon est que la plupart des résines ont une capacité finie de lier les protéines; surcharger une colonne en appliquant trop d’échantillon peut nuire à la séparation.
Lavage de colonne
Une fois les protéines immobilisées sur la phase stationnaire, les protéines n’interagissant que faiblement ou non spécifiquement avec la résine sont éliminées par lavage de la colonne avec plusieurs volumes de colonne de tampon de lavage. Ce tampon de lavage peut avoir la même composition que le tampon d’équilibration ou contenir des composants perturbant des interactions spécifiques faibles.
Par exemple, la chromatographie d’affinité des métaux immobilisés (IMAC) élue les protéines liées à la résine avec une forte concentration d’immidazole. Une pratique courante consiste à utiliser un tampon de lavage qui comprend une concentration intermédiaire d’immidazole pour éliminer les protéines contaminantes qui ne sont que faiblement liées à la résine.
La colonne est lavée jusqu’à ce qu’aucune protéine ne soit détectée dans l’éluat. Lors de l’utilisation d’un système de chromatographie avec un détecteur UV, la colonne est lavée jusqu’à ce que la lecture d’absorption de 280 nm revienne à la ligne de base.
Élution de l’échantillon
Après que toutes les protéines non spécifiques et faiblement interagissantes ont été lavées de la résine, les protéines qui interagissent fortement avec la résine sont éluées de la colonne en modifiant la composition du tampon qui est passé sur la résine.
En chromatographie échangeuse d’ions, les protéines sont éluées avec des tampons à haute résistance ionique ou avec un changement de pH pour perturber les interactions électrostatiques qui ont immobilisé la protéine d’intérêt. Les protéines liées à une résine d’interaction hydrophobe, inversement, sont éluées en abaissant la force ionique du tampon. En chromatographie d’affinité, les protéines sont généralement éluées de la colonne par l’introduction d’un ligand concurrent ou par clivage de l’étiquette d’affinité et peuvent également être éluées à l’aide de tampons à haute teneur en sel ou en modifiant le pH. D’autres protocoles d’élution peuvent impliquer le mélange de solvants de polarité variable pour ajuster la solubilité de chaque composant dans la phase mobile.
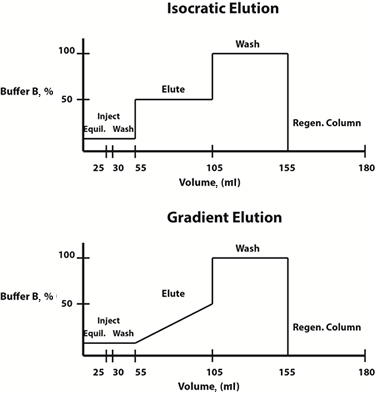
Fig. 3: Exemples de diagrammes de composition de tampon pour les protocoles d’élution isocratiques (en haut) et de gradient (en bas).
Les conditions d’élution peuvent être modifiées de manière linéaire ou par étapes. Souvent, un protocole d’élution par gradient, dans lequel la composition de la phase mobile évolue linéairement au cours du temps, est choisi pour déterminer le profil d’élution et la concentration en tampon d’élution à laquelle la protéine d’intérêt est libérée de la résine. Une fois cette concentration déterminée, pour gagner du temps, un protocole d’élution isocratique par étapes, dans lequel la composition de la phase mobile est constante à chaque étape, peut être conçu pour de futures purifications.
Remarque: La chromatographie d’exclusion de taille ne nécessite pas de changements de tampon car elle ne dépend pas d’interactions spécifiques entre la phase mobile et la phase stationnaire. Il n’y a pas de véritables étapes de lavage et d’élution, car la SEC repose uniquement sur le fait que les grosses molécules sont retardées par des billes poreuses, alors que les petites molécules traversent la résine avec une interaction minimale de la résine.
Lavage final de la colonne
Après élution de la protéine d’intérêt à partir de la résine, toutes les protéines qui restent liées à la résine sont éluées en augmentant la résistance du tampon d’élution. Cette étape permet de réutiliser les colonnes pour de futures séparations.
Régénération de colonne
Après décapage des composés restants liés au milieu, la colonne est alors soit saturée de tampon d’équilibration pour une réutilisation ultérieure, soit remplie d’un tampon de stockage.
Leave a Reply