Cromatografia Liquida Principi
Indipendentemente dal tipo di interazioni che vengono sfruttati, liquido cromatografia su colonna è svolta in sei fasi:
- Equilibratura della colonna
- caricamento del Campione
- Lavaggio
- Eluizione
- Finale di lavaggio della colonna
- Colonna di rigenerazione
Equilibratura della Colonna
la Maggior parte di cromatografia liquida protocolli di iniziare con una resina di equilibrazione passo. Un tampone che è compatibile con la proteina di interesse e la resina di scelta viene passato sopra la colonna. Una pratica comune è quella di equilibrare la colonna con 5-10 volumi di colonna (CVs) di buffer di equilibrazione.
Ad esempio, il legame delle proteine alle resine idrofobiche di interazione è più efficiente ad alta resistenza ionica. Prima dell’applicazione del campione, la resina è quindi equilibrata in un tampone di elevata resistenza ionica.
Le proprietà della proteina di interesse sono anche considerate nella selezione del buffer di equilibrazione, in quanto i fattori tampone come la forza ionica sono limitati dalla stabilità della proteina; in genere, si eviterebbero condizioni tampone di equilibrazione che denaturerebbero la proteina di interesse o impedirebbero che interagisca con la fase stazionaria.
Caricamento del campione
Dopo l’equilibratura, il campione viene caricato sulla colonna. Il campione viene generalmente caricato in un tampone con la stessa composizione del tampone di equilibrazione per massimizzare l’interazione proteica con la fase stazionaria.
Il campione può essere caricato manualmente o utilizzando una pompa di campionamento. Alcuni tipi di cromatografia limitano il volume del campione che può essere caricato sulla colonna. Un’altra importante considerazione di caricamento del campione è che la maggior parte delle resine ha una capacità finita di legare le proteine; sovraccaricare una colonna applicando troppo campione può influire negativamente sulla separazione.
Lavaggio colonna
Una volta che le proteine sono state immobilizzate in fase stazionaria, le proteine che interagiscono solo debolmente o non specificatamente con la resina vengono rimosse lavando la colonna con diversi volumi di tampone di lavaggio. Questo tampone di lavaggio può avere la stessa composizione del tampone di equilibratura o contenere componenti che interrompono interazioni specifiche deboli.
Ad esempio, la cromatografia ad affinità di metallo immobilizzato (IMAC) eluta le proteine legate alla resina con un’alta concentrazione di immidazolo. Una pratica comune è quella di utilizzare un tampone di lavaggio che include una concentrazione intermedia di immidazolo per eliminare le proteine contaminanti che sono solo debolmente legate alla resina.
La colonna viene lavata fino a quando non viene rilevata alcuna proteina nell’eluato. Quando si utilizza un sistema di cromatografia con un rivelatore UV, la colonna viene lavata fino a quando la lettura di assorbimento di 280 nm ritorna alla linea di base.
Eluizione del campione
Dopo che tutte le proteine non specifiche e debolmente interagenti sono state lavate via dalla resina, le proteine che interagiscono fortemente con la resina vengono eluite dalla colonna modificando la composizione del tampone che viene passato sopra la resina.
Nella cromatografia a scambio ionico, le proteine vengono eluite con tamponi ad alta resistenza ionica o con un cambiamento nel pH per interrompere le interazioni elettrostatiche che immobilizzavano la proteina di interesse. Le proteine legate a una resina di interazione idrofobica, al contrario, vengono eluite abbassando la forza ionica del buffer. In cromatografia di affinità, le proteine sono eluted comunemente dalla colonna dall’introduzione di un legante concorrente o spaccando l’etichetta di affinità e possono anche essere eluted facendo uso dei tamponi alto-salini o alterando il pH. Altri protocolli di eluizione possono comportare la miscelazione di solventi di polarità variabile per regolare la solubilità di ciascun componente nella fase mobile.
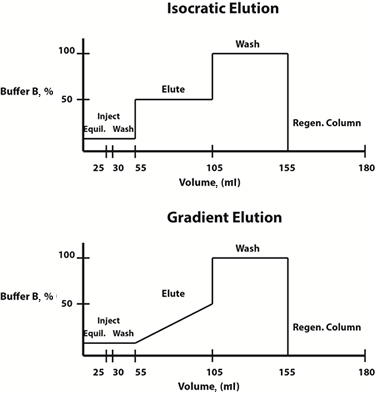
Fig. 3: Esempi di diagrammi di composizione buffer per protocolli di eluizione isocratica (in alto) e gradiente (in basso).
Le condizioni di eluizione possono essere modificate in modo lineare o graduale. Spesso, un protocollo di eluizione del gradiente, in cui la composizione della fase mobile cambia linearmente nel tempo, viene scelto per determinare il profilo di eluizione e la concentrazione del tampone di eluizione in cui la proteina di interesse viene liberata dalla resina. Una volta determinata questa concentrazione, per risparmiare tempo, è possibile progettare un protocollo di eluizione isocratica graduale, in cui la composizione della fase mobile è costante ad ogni fase, per future purificazioni.
Nota: La cromatografia di esclusione di dimensione non richiede i cambiamenti dell’amplificatore poiché non dipende dalle interazioni specifiche fra la fase mobile e la fase stazionaria. Non ci sono veri passaggi di lavaggio ed eluizione, poiché SEC si basa esclusivamente sul fatto che le grandi molecole sono ritardate da perline porose, mentre piccole molecole passano attraverso la resina con una minima interazione con la resina.
Lavaggio finale della colonna
Dopo che la proteina di interesse è stata eluita dalla resina, tutte le proteine che rimangono legate alla resina vengono eluite aumentando la resistenza del tampone di eluizione. Questo passaggio consente di riutilizzare le colonne per le separazioni future.
Rigenerazione della colonna
Dopo aver rimosso i composti rimanenti legati al supporto, la colonna viene quindi saturata con buffer di equilibrazione per il successivo riutilizzo o riempita con un buffer di archiviazione.
Leave a Reply