Il colore dell’indicatore della fenolftaleina nella soluzione di base è:(A) Giallo(B) Verde(C) Rosa(D) Arancione
Suggerimento: La fenolftaleina è un acido debole e quindi rilascia ioni {{H^+} ions in soluzione. L’anione si forma quindi in colore e indica il punto finale. L’aggiunta di una base alla fenolftaleina fa sì che l’equilibrio si sposti verso il mezzo acido e rilasci più ioni {{H^+} ions.
Completa soluzione passo passo:
-La fenolftaleina è un indicatore sintetico con una formula molecolare di {{C_ {20}} {H_{14}} {O_4}$. Appartiene alla classe delle ftaleine dei coloranti ed è più spesso usato come indicatore nelle titolazioni acido-base. Per sua natura, ha una solubilità molto bassa in acqua e quindi per l’uso in esperimenti, è sciolto in alcool.
La sua struttura è:
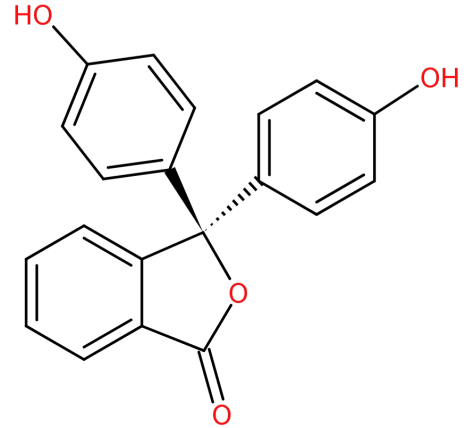
-È formato dalla condensazione di anidride ftalica con due equivalenti di fenolo in condizioni acide.
-È un acido debole e quindi ha la capacità di perdere ions{H^+} ions ioni in soluzione. Prima di perdere lo ion {H^+}$, la molecola di fenolftaleina è incolore, ma dopo aver perso lo ion{H^+} forms forma lo phen fenolftaleina che è di colore rosa.
Secondo il principio di Le-Chatelier, se aggiungiamo una base alla fenolftaleina, l’equilibrio si sposterà verso il mezzo acido portando al rilascio di più ioni {{H^+} ions. Trasformando così la soluzione da incolore a rosa.
Quindi possiamo dire che la fenolftaleina rimane incolore nelle soluzioni acide e neutre e diventa rosa nelle soluzioni di base. Rimane incolore fino a pH 8.5, mentre al di sopra che si trasforma rosa al rosso intenso a colori.
– Allo stato liquido è incolore, ma quando si trova in forma cristallina solida, la fenolftaleina è di colore da bianco giallastro a arancione pallido o polvere cristallina bianca fine.
-La fenolftaleina è ampiamente utilizzata come indicatore di pH e agente di laboratorio. Inoltre è usato nelle titolazioni acido-base come indicatore, medicinally come lassativo ed in prova di Kastle-Mayer anche. Insieme al rosso metilico, al timolo blu e al bromotimolo blu, può anche fungere da componente dell’indicatore universale.
Quindi, l’opzione corretta sarà: (C) Rosa.
Nota: Può adottare fino a 4 stati differenti nelle soluzioni acquose dovuto i cambiamenti di pH. Quando le condizioni sono fortemente acide, esiste nella forma protonata (H H{\ln ^ + }$), che ha colorazione arancione. Quando le condizioni sono tra fortemente acide e leggermente basiche, esiste in forma di lattone (Hln) che è incolore. In condizioni di base esiste come forma fenolata doppiamente deprotonata ({{\ln ^{2 – }}$) che è incolore e in condizioni fortemente basiche forma form\ln {(OH)^{3 -}} form forma che è incolore.
Leave a Reply