液体クロマトグラフィーの原理
利用されている相互作用にかかわらず、液体カラムクロマトグラフィーは6つのステップで実行されます。:
- カラム平衡
- サンプルローディング
- 洗浄
- 溶出
- 最終カラム洗浄
- カラム再生
カラム平衡
ほとんどの液体クロマトグラフィプロト 興味の蛋白質および選択の樹脂と互換性がある緩衝はコラムに渡される。 一般的な方法は、カラムを5〜1 0カラム容量(Cv)の平衡化緩衝液で平衡化することである。
例えば、疎水性相互作用樹脂へのタンパク質の結合は、高いイオン強度で最も効率的である。 従って、試料を塗布する前に、樹脂は、高いイオン強度の緩衝液中で平衡化される。
目的のタンパク質の特性は、イオン強度などの緩衝因子がタンパク質安定性によって制限されるため、平衡緩衝剤の選択においても考慮される。
サンプルロード
平衡化後、サンプルをカラムにロードします。 試料は、一般的に、静止相とのタンパク質相互作用を最大化するために、平衡化緩衝液と同じ組成を有する緩衝液中に装填される。
サンプルは手動またはサンプルポンプを使用して荷を積むことができます。 クロマトグラフィーの種類によっては、カラムにロードできるサンプルの量が制限されます。 もう一つの重要なサンプル負荷の考察はほとんどの樹脂に蛋白質を結合する有限な容量があることである;たくさんのサンプルを加えることによ
カラム洗浄
タンパク質が固定相に固定されたら、樹脂と弱くまたは非特異的にのみ相互作用するタンパク質は、数カラム容量の洗浄緩衝液でカラムを洗浄することによって除去される。 この洗浄緩衝液は、平衡化緩衝液と同じ組成を有することができ、または弱い特異的相互作用を破壊する成分を含有することができる。
例えば、固定化金属アフィニティクロマトグラフィー(IMAC)は、樹脂に結合したタンパク質を高濃度のイミダゾールで溶出する。 一般的な方法は、樹脂に弱く結合しているだけの汚染タンパク質を除去するために、中間濃度のイミダゾールを含む洗浄緩衝液を使用することである。
溶出液中にタンパク質が検出されないまでカラムを洗浄する。 紫外線探知器が付いているクロマトグラフィーシステムを使用するとき、280nmの吸収の読書がベースラインに戻るまでカラムは洗浄されます。
サンプル溶出
すべての非特異的かつ弱相互作用するタンパク質を樹脂から洗浄した後、樹脂上に通過する緩衝液の組成を変更することによ
イオン交換クロマトグラフィーでは、タンパク質を高イオン強度バッファーまたはpHの変化で溶出し、目的のタンパク質を固定化した静電相互作用 疎水性相互作用樹脂に結合したタンパク質は、逆に、緩衝液のイオン強度を低下させることによって溶出される。 アフィニティークロマトグラフィーでは、タンパク質は一般に、競合リガンドの導入またはアフィニティタグの切断によってカラムから溶出され、高塩バッファを使用して溶出されるか、またはpHを変更することができる。 他の溶出プロトコルは、移動相における各成分の溶解度を調整するために、様々な極性の溶媒を混合することを含むことができる。
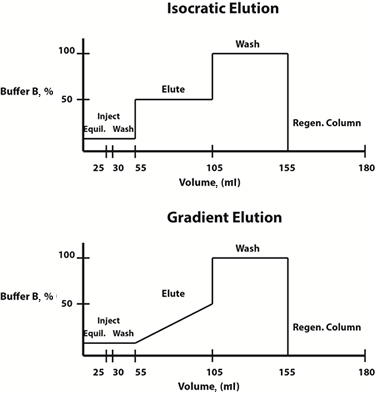
図3:アイソクラティック(上)および勾配(下)溶出プロトコル用の緩衝液組成図の例。
溶出条件は、線形勾配または段階的な方法で変更することができます。 多くの場合、移動相の組成が時間の経過とともに直線的に変化する勾配溶出プロトコルは、溶出プロファイルおよび目的のタンパク質が樹脂から この濃度が決定されると、時間を節約するために、移動相の組成が各ステップで一定である段階的なアイソクラティック溶出プロトコールを、将来の精製のために設計することができる。
: サイズ排除クロマトグラフィーは、移動相と静止相との間の特定の相互作用に依存しないので、緩衝液の変化を必要としない。 SECは、大きな分子が多孔質ビーズによって遅延されるのに対し、小さな分子が最小限の樹脂相互作用で樹脂を通過するという事実にのみ依存するため、真の洗浄および溶出ステップはありません。
最終カラム洗浄
目的のタンパク質が樹脂から溶出された後、溶出緩衝液の強度を高めることにより、樹脂に結合したままのタンパク質が溶出され このステップでは、将来の分離のために列を再利用できます。
カラム再生
培地に結合した残りの化合物を除去した後、カラムを平衡化緩衝液で飽和させて再使用するか、貯蔵緩衝液で充填する。
Leave a Reply