Prinsipper For Væskekromatografi
uavhengig av interaksjonene som utnyttes, utføres væskekromatografi i seks trinn:
- Kolonne likevekt
- sample loading
- Vasking
- Eluering
- siste kolonne vasking
- Kolonne regenerering
Kolonne Likevekt
de fleste flytende kromatografi protokoller begynner med en harpiks likevekt trinn. En buffer som er kompatibel med protein av interesse og harpiks av valget er gått over kolonnen. En vanlig praksis er å balansere kolonnen med 5-10 kolonnevolumer (CVs) av likevektsbuffer.
for eksempel er binding av proteiner til hydrofobe interaksjonsharpikser mest effektive ved høy ionisk styrke. Før prøveapplikasjon er harpiksen derfor equilibrated i en buffer med høy ionisk styrke.
egenskapene til proteinet av interesse vurderes også i likevektsbuffervalg, da bufferfaktorer som ionisk styrke er begrenset av proteinstabilitet; typisk ville man unngå likevektsbufferforhold som ville denaturere proteinet av interesse eller hindre det i å interagere med den stasjonære fasen.
Prøvebelastning
etter likevekt lastes prøven inn i kolonnen. Prøven er vanligvis lastet i en buffer med samme sammensetning som likevektsbufferen for å maksimere proteininteraksjonen med den stasjonære fasen.
Prøven kan lastes manuelt eller ved hjelp av en prøvepumpe. Noen typer kromatografi begrenser volumet av prøve som kan lastes inn på kolonnen. En annen viktig prøve lasting vurdering er at de fleste harpiks har en endelig kapasitet til å binde protein; overbelastning av en kolonne ved å bruke for mye prøve kan påvirke separasjon.
Kolonnevask
når proteiner Har blitt immobilisert på den stasjonære fasen, fjernes proteiner som bare virker svakt eller ikke-spesifikt med harpiksen ved å vaske kolonnen med flere kolonnevolumer av vaskebuffer. Denne vaskebufferen kan ha samme sammensetning som likevektsbufferen eller inneholde komponenter som forstyrrer svake spesifikke interaksjoner.
for eksempel eluerer immobilisert metallaffinitetskromatografi (IMAC) proteiner bundet til harpiksen med høy konsentrasjon av immidazol. En vanlig praksis er å bruke en vaskebuffer som inneholder en mellomkonsentrasjon av immidazol for å eliminere forurensende proteiner som bare er svakt bundet til harpiksen.
kolonnen vaskes til det ikke oppdages protein i eluatet. Når du bruker et kromatografisystem med UV-detektor, vaskes kolonnen til 280 nm absorpsjonsavlesning vender tilbake til grunnlinjen.
Prøveluering
etter at alle ikke-spesifikke og svakt interagerende proteiner har blitt vasket av harpiksen, blir proteiner som interagerer sterkt med harpiksen eluert fra kolonnen ved å endre sammensetningen av bufferen som passerer over harpiksen.
i ionbytterkromatografi elueres proteiner med høy–ionisk styrkebuffere eller med en endring i pH for å forstyrre de elektrostatiske interaksjonene som immobiliserte proteinet av interesse. Proteiner bundet til en hydrofob interaksjonsharpiks, omvendt, elueres ved å senke bufferens ioniske styrke. I affinitetskromatografi blir proteiner ofte eluert fra kolonnen ved innføring av en konkurrerende ligand eller ved å spalte affinitetskoden og kan også elueres ved hjelp av høy saltbuffere eller endring av pH. Andre elueringsprotokoller kan innebære å blande løsningsmidler med varierende polaritet for å justere løseligheten til hver komponent i mobilfasen.
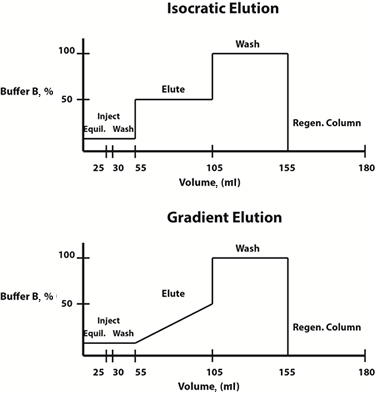
Fig. 3: Eksempel buffersammensetningsdiagrammer for isokratiske (øverst) og gradient (nederst) elueringsprotokoller.
Elueringsforhold kan enten endres i lineær gradient eller trinnvis. Ofte velges en gradientelueringsprotokoll, hvor sammensetningen av mobilfasen endres lineært over tid, for å bestemme elueringsprofilen og elueringsbufferkonsentrasjonen hvor proteinet av interesse frigjøres fra harpiksen. Når denne konsentrasjonen er bestemt, for å spare tid, kan en trinnvis isokratisk elueringsprotokoll, der sammensetningen av mobilfasen er konstant i hvert trinn, utformes for fremtidige rensninger.
Notat: Størrelseskromatografi krever ikke bufferendringer siden det ikke er avhengig av spesifikke interaksjoner mellom mobilfasen og den stasjonære fasen. DET er ingen sanne vaske-og elueringstrinn, DA SEC bare er avhengig av at store molekyler er retardert av porøse perler, mens små molekyler passerer gjennom harpiksen med minimal harpiksinteraksjon.
Siste Kolonnevask
etter at proteinet av interesse er eluert fra harpiksen, elueres eventuelle proteiner som forblir bundet til harpiksen ved å øke styrken til elueringsbufferen. Dette trinnet tillater kolonner som skal gjenbrukes for fremtidige separasjoner.
Kolonneregenerering
etter stripping av de gjenværende forbindelsene bundet til mediet, blir kolonnen enten mettet med likevektsbuffer for senere gjenbruk eller fylt med en lagringsbuffer.
Leave a Reply