de kleur van de fenolftaleinindicator in basic solution is:(a) geel(B) groen(C) Roze(D) Oranje
Hint: Fenolftalein is een zwak zuur en geeft dus ${H^ + }$ ionen in oplossing af. Het anion vormt zich dus in kleur en geeft het eindpunt aan. Het toevoegen van een base aan fenolftaleïne zorgt ervoor dat het evenwicht verschuift naar het zure medium en meer ${H^ + }$ ionen vrijmaakt.
stapsgewijze oplossing voltooien:
– fenolftaleïne is een synthetische indicator met een moleculaire formule van ${C_{20}}{H_{14}}{O_4}$. Het behoort tot de ftaleïne-klasse van kleurstoffen en wordt meestal gebruikt als indicator in zuur-base titraties. Van nature heeft het een zeer lage oplosbaarheid in water en dus voor gebruik in experimenten wordt het opgelost in alcohol.
de structuur is:
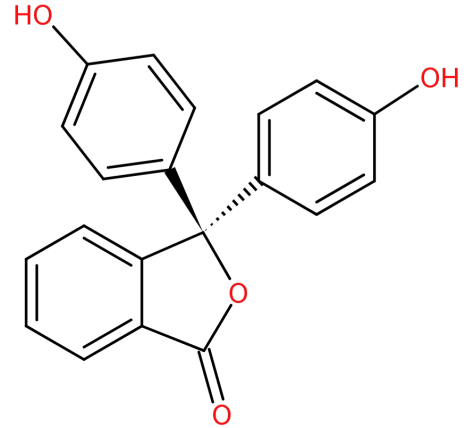
-het wordt gevormd door de condensatie van ftaalzuuranhydride met twee equivalenten fenol onder zure omstandigheden.
– het is een zwak zuur en heeft dus de mogelijkheid om ${H^ + }$ ionen in oplossing te verliezen. Voordat het ion ${h^ + }$ verliest, is het fenolftaleïnemolecuul kleurloos, maar na het verliezen van ${H^ + }$ ion vormt het het fenolftaleïneion dat roze van kleur is.
volgens het principe van Le-Chatelier zal, als we een base toevoegen aan fenolftaleïne, het evenwicht verschuiven naar zuur medium, wat leidt tot het vrijkomen van meer ${H^ + }$ ionen. Zo wordt de oplossing van kleurloos naar roze.
daarom kunnen we zeggen dat fenolftaleïne kleurloos blijft in zure en neutrale oplossingen en roze wordt in basische oplossingen. Het blijft kleurloos tot pH 8.5, terwijl boven dat het roze tot diep rood van kleur wordt.
-in vloeibare toestand is het kleurloos, maar wanneer het wordt aangetroffen in vaste kristallijne vorm is fenolftaleïne geligwit tot lichtoranje of fijn wit kristallijn poeder.
– fenolftaleïne wordt veel gebruikt als pH-indicator en als laboratoriummiddel. Het wordt ook gebruikt in zuur-base titraties als indicator, medicinaal als laxeermiddel en in Kastle-Mayer test ook. Samen met methylrood, thymolblauw en broomthymolblauw, kan het ook fungeren als een component van universele indicator.
dus de juiste optie is: (C) Pink.
Noot: Het kan tot 4 verschillende staten in waterige oplossingen goedkeuren toe te schrijven aan de pH veranderingen. Wanneer de omstandigheden sterk zuur zijn, bestaat het in de geprotoneerde vorm ($h{\ln ^+}$), die oranje kleur heeft. Wanneer de omstandigheden tussen sterk zuur en licht basisch zijn, bestaat het in lactonvorm (Hln) die kleurloos is. Onder basisomstandigheden bestaat het als dubbel gedeprotoneerde fenolaatvorm (${\ln ^{2 -}}$) die kleurloos is en onder sterk basisomstandigheden vormt het $\ln {(OH)^{3 – }}$ vorm die kleurloos is.
Leave a Reply