Zasady chromatografii cieczowej
niezależnie od wykorzystywanych interakcji, chromatografia cieczowa jest przeprowadzana w sześciu etapach:
- równoważenie kolumny
- Ładowanie próbki
- mycie
- Elucja
- końcowe mycie kolumny
- regeneracja kolumny
Równoważenie kolumny
większość protokołów chromatografii cieczowej rozpoczyna się etapem równoważenia żywicy. Bufor, który jest zgodny z interesującym białkiem i wybraną żywicą, jest przepuszczany przez kolumnę. Powszechną praktyką jest równoważenie kolumny z 5-10 objętościami kolumn (CVs) bufora do równoważenia.
na przykład wiązanie białek z hydrofobowymi żywicami interakcyjnymi jest najbardziej wydajne przy wysokiej sile jonowej. Przed nałożeniem próbki żywica jest zatem równoważona w buforze o wysokiej wytrzymałości jonowej.
właściwości białka będącego przedmiotem zainteresowania są również brane pod uwagę przy wyborze bufora równowagi, ponieważ czynniki buforowe, takie jak siła jonowa, są ograniczone przez stabilność białka; zazwyczaj można by uniknąć warunków bufora równowagi, które denaturowałyby białko będące przedmiotem zainteresowania lub uniemożliwiały mu interakcję z fazą stacjonarną.
Ładowanie próbki
po zrównoważeniu próbka jest ładowana na kolumnę. Próbka jest zazwyczaj ładowana w buforze o takim samym składzie jak bufor do równoważenia, aby zmaksymalizować interakcję białka z fazą stacjonarną.
próbkę można załadować ręcznie lub za pomocą pompy do próbek. Niektóre rodzaje chromatografii ograniczają objętość próbki, którą można załadować na kolumnę. Innym ważnym obciążeniem próbki jest to, że większość żywic ma skończoną zdolność wiązania białka; przeciążenie kolumny przez zastosowanie zbyt dużej ilości próbki może niekorzystnie wpływać na separację.
mycie kolumny
po unieruchomieniu białek w fazie stacjonarnej, białka, które oddziałują tylko słabo lub niespecyficznie z żywicą, są usuwane przez przemywanie kolumny kilkoma objętościami kolumny buforu do mycia. Bufor do płukania może mieć taki sam skład jak bufor do równoważenia lub zawierać składniki, które zakłócają słabe oddziaływania specyficzne.
na przykład chromatografia immobilized-metal affinity (iMac) eluuje białka związane z żywicą z wysokim stężeniem immidazolu. Powszechną praktyką jest stosowanie buforu do płukania, który zawiera pośrednie stężenie immidazolu w celu wyeliminowania zanieczyszczających białek, które są słabo związane z żywicą.
kolumnę przemywa się, aż w eluacie nie zostanie wykryte żadne białko. W przypadku stosowania systemu chromatograficznego z detektorem UV kolumnę przemywa się do momentu powrotu odczytu absorpcji 280 nm do wartości wyjściowej.
wymywanie próbki
po tym, jak wszystkie niespecyficznie i słabo oddziałujące białka zostały zmyte z żywicy, białka, które silnie oddziałują z żywicą, są eluowane z kolumny przez zmianę składu buforu, który jest przepuszczany przez żywicę.
w chromatografii jonowymiennej białka są eluowane buforami o wysokiej wytrzymałości jonowej lub ze zmianą pH w celu zakłócenia oddziaływań elektrostatycznych, które unieruchomiły interesujące białko. Białka związane z hydrofobową żywicą interakcyjną są eluowane przez obniżenie siły jonowej buforu. W chromatografii powinowactwa, białka są zwykle eluowane z kolumny przez wprowadzenie konkurencyjnego ligandu lub przez rozszczepianie znacznika powinowactwa, a także mogą być eluowane przy użyciu buforów o wysokiej zawartości soli lub zmieniając pH. Inne protokoły elucji mogą obejmować mieszanie rozpuszczalników o różnej polaryzacji w celu dostrojenia rozpuszczalności każdego składnika w fazie ruchomej.
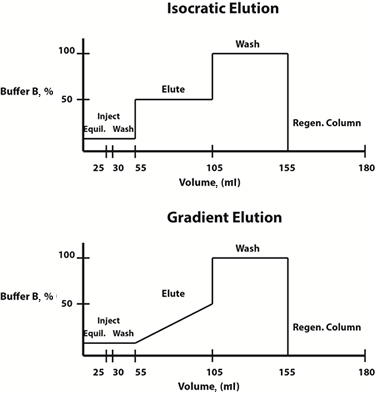
3: przykładowe diagramy składu buforów dla izokratycznych (góra) i gradientowych (dół) protokołów elucji.
Warunki elucji mogą być zmieniane w sposób liniowy lub stopniowy. Często, gradientowy protokół elucji, w którym skład fazy ruchomej zmienia się liniowo w czasie, jest wybierany w celu określenia profilu elucji i stężenia buforu elucyjnego, przy którym interesujące białko jest uwalniane z żywicy. Po określeniu tego stężenia, aby zaoszczędzić czas, można zaprojektować stopniowy izokratyczny protokół elucji, w którym skład fazy ruchomej jest stały na każdym etapie, do przyszłych oczyszczeń.
Uwaga: Chromatografia wykluczająca wielkość nie wymaga zmian bufora, ponieważ nie zależy od specyficznych interakcji między fazą ruchomą a fazą stacjonarną. Nie ma prawdziwych etapów mycia i elucji, ponieważ SEC opiera się wyłącznie na fakcie, że duże cząsteczki są opóźniane przez porowate kulki, podczas gdy małe cząsteczki przechodzą przez żywicę przy minimalnym oddziaływaniu żywicy.
końcowe płukanie kolumny
po elucji interesującego białka z żywicy, wszelkie białka pozostające związane z żywicą są eluowane przez zwiększenie siły buforu elucyjnego. Ten krok pozwala na ponowne wykorzystanie kolumn do przyszłych separacji.
regeneracja kolumny
po odpędzeniu pozostałych związków związanych z podłożem, kolumna jest następnie nasycona buforem do równoważenia w celu późniejszego ponownego użycia lub wypełniona buforem do przechowywania.
Leave a Reply