Principios de Cromatografía Líquida
Independientemente de las interacciones que se están explotando, la cromatografía de columna líquida se lleva a cabo en seis pasos:
- Equilibrado de columnas
- Carga de muestras
- Lavado
- Elución
- Lavado final de columnas
- Regeneración de columnas
Equilibrado de columnas
La mayoría de los protocolos de cromatografía líquida comienzan con una etapa de equilibrado de resina. Un tampón que es compatible con la proteína de interés y la resina de elección se pasa sobre la columna. Una práctica común es equilibrar la columna con 5-10 volúmenes de columna (CVs) de búfer de equilibrio.
Por ejemplo, la unión de proteínas a resinas de interacción hidrofóbica es más eficiente con una alta resistencia iónica. Por lo tanto, antes de la aplicación de la muestra, la resina se equilibra en un tampón de alta resistencia iónica.
Las propiedades de la proteína de interés también se consideran en la selección de tampón de equilibrio, ya que los factores de tampón, como la fuerza iónica, están limitados por la estabilidad de la proteína; típicamente, se evitarían las condiciones de tampón de equilibrio que desnaturalizarían la proteína de interés o evitarían que interactuara con la fase estacionaria.
Carga de la muestra
Después del equilibrado, la muestra se carga en la columna. La muestra generalmente se carga en un tampón con la misma composición que el tampón de equilibrio para maximizar la interacción de la proteína con la fase estacionaria.
La muestra se puede cargar manualmente o utilizando una bomba de muestra. Algunos tipos de cromatografía limitan el volumen de muestra que se puede cargar en la columna. Otra consideración importante de carga de muestras es que la mayoría de las resinas tienen una capacidad finita para unirse a proteínas; sobrecargar una columna aplicando demasiada muestra puede afectar negativamente la separación.
Lavado de columnas
Una vez que las proteínas se han inmovilizado en la fase estacionaria, las proteínas que interactúan solo débil o no específicamente con la resina se eliminan lavando la columna con varios volúmenes de tampón de lavado. Este tampón de lavado puede tener la misma composición que el tampón de equilibrio o contener componentes que interrumpen interacciones específicas débiles.
Por ejemplo, la cromatografía de afinidad de metal inmovilizado (IMAC) eluta proteínas unidas a la resina con una alta concentración de immidazol. Una práctica común es usar un tampón de lavado que incluya una concentración intermedia de immidazol para eliminar las proteínas contaminantes que solo están débilmente unidas a la resina.
La columna se lava hasta que no se detecte ninguna proteína en el eluato. Cuando se utiliza un sistema de cromatografía con detector UV, la columna se lava hasta que la lectura de absorción de 280 nm vuelva a la línea de base.
Elución de la muestra
Después de que todas las proteínas que interactúan débil y no específica se hayan lavado de la resina, las proteínas que interactúan fuertemente con la resina se eluyen de la columna cambiando la composición del tampón que se pasa sobre la resina.
En la cromatografía de intercambio iónico, las proteínas se eluyen con tampones de alta resistencia iónica o con un cambio en el pH para interrumpir las interacciones electrostáticas que inmovilizaron la proteína de interés. Las proteínas unidas a una resina de interacción hidrofóbica, por el contrario, se elutan al reducir la fuerza iónica del tampón. En la cromatografía de afinidad, las proteínas se elutan comúnmente de la columna mediante la introducción de un ligando competidor o mediante la escisión de la etiqueta de afinidad y también se pueden elutar utilizando tampones con alto contenido de sal o alterando el pH. Otros protocolos de elución pueden implicar la mezcla de disolventes de polaridad variable para ajustar la solubilidad de cada componente en la fase móvil.
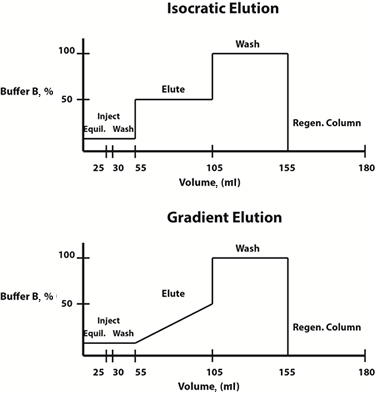
Fig. 3: Ejemplo de diagramas de composición de búfer para protocolos de elución isocráticos (superior) y de gradiente (inferior).
Las condiciones de elución se pueden cambiar de forma lineal o por pasos. A menudo, se elige un protocolo de elución de gradiente, en el que la composición de la fase móvil cambia linealmente con el tiempo, para determinar el perfil de elución y la concentración de tampón de elución a la que la proteína de interés se libera de la resina. Una vez determinada esta concentración, para ahorrar tiempo, se puede diseñar un protocolo de elución isocrático escalonado, en el que la composición de la fase móvil es constante en cada paso, para futuras purificaciones.
Nota: La cromatografía de exclusión de tamaño no requiere cambios en el búfer, ya que no depende de interacciones específicas entre la fase móvil y la fase estacionaria. No hay pasos verdaderos de lavado y elución, ya que la SEC se basa únicamente en el hecho de que las moléculas grandes son retardadas por perlas porosas, mientras que las moléculas pequeñas pasan a través de la resina con una interacción mínima de la resina.
Lavado final de la columna
Después de que la proteína de interés se ha eluido de la resina, cualquier proteína que permanezca unida a la resina se eluye aumentando la resistencia del tampón de elución. Este paso permite que las columnas se reutilicen para futuras separaciones.
Regeneración de columna
Después de eliminar los compuestos restantes unidos al medio, la columna se satura con un tampón de equilibrio para su posterior reutilización o se llena con un tampón de almacenamiento.
Leave a Reply