Cromatografia Líquida de Princípios
Independentemente das interações que estão sendo explorados, coluna líquida cromatografia é realizado em seis etapas:
- Coluna de equilíbrio
- Exemplo de carregamento de
- Lavar
- Eluição
- Final de coluna de lavagem
- Coluna de regeneração
Coluna de Equilíbrio
Mais de cromatografia líquida de protocolos de começar com uma resina de equilíbrio passo. Um tampão compatível com a proteína de interesse e a resina de escolha é passado sobre a coluna. Uma prática comum é equilibrar a coluna com 5-10 volumes de coluna (CVs) de buffer de equilíbrio.
por exemplo, a ligação de proteínas a resinas de interação hidrofóbica é mais eficiente em alta resistência iônica. Antes da aplicação da amostra, a resina é, portanto, equilibrada em um tampão de alta resistência iônica.
As propriedades da proteína de interesse são também consideradas no equilíbrio do buffer de seleção, como buffer de fatores como a força iônica são limitados pela proteína estabilidade; normalmente, seria de evitar equilíbrio buffer de condições que seria desnaturar a proteína de interesse ou o impede de interagir com a fase estacionária.
Carga Da Amostra
após o equilíbrio, a amostra é carregada na coluna. A amostra é geralmente carregada em um buffer com a mesma composição que o buffer de equilíbrio para maximizar a interação da proteína com a fase estacionária.
a amostra pode ser carregada manualmente ou usando uma bomba de amostra. Alguns tipos de cromatografia limitam o volume de amostra que pode ser carregado na coluna. Outra consideração importante de carregamento de amostras é que a maioria das resinas tem uma capacidade finita de se ligar à proteína; sobrecarregar uma coluna aplicando muita amostra pode afetar adversamente a separação.
Lavagem da coluna
uma vez que as proteínas foram imobilizadas na fase estacionária, as proteínas que interagem apenas fracamente ou não especificamente com a resina são removidas lavando a coluna com vários volumes de coluna de tampão de lavagem. Este tampão de lavagem pode ter a mesma composição que o tampão de equilíbrio ou conter componentes que interrompem interações específicas fracas.
por exemplo, a cromatografia de afinidade imobilizado-metal (IMAC) eluta proteínas ligadas à resina com alta concentração de imidazol. Uma prática comum é usar um tampão de lavagem que inclua uma concentração intermediária de imidazol para eliminar proteínas contaminantes que estão apenas fracamente ligadas à resina.
a coluna é lavada até que nenhuma proteína seja detectada no eluato. Ao usar um sistema de cromatografia com um detector UV, a coluna é lavada até que a leitura de absorção de 280 nm retorne à linha de base.
Exemplo de Eluição
Depois de todas as nonspecifically e interacção fraca proteínas foram lavados da resina, proteínas que interagem fortemente com a resina são eluídas da coluna alterando a composição da memória intermédia que é passado sobre a resina.
na cromatografia de troca iônica, as proteínas são eluídas com buffers de alta resistência iônica ou com uma mudança no pH para interromper as interações eletrostáticas que imobilizaram a proteína de interesse. As proteínas ligadas a uma resina de interação hidrofóbica, inversamente, são eluídas diminuindo a força iônica do tampão. Na cromatografia de afinidade, as proteínas são comumente eluídas da coluna pela introdução de um ligante concorrente ou pela clivagem da etiqueta de afinidade e também podem ser eluídas usando buffers com alto teor de sal ou alterando o pH. Outros protocolos de eluição podem envolver solventes de mistura de polaridade variável para ajustar a solubilidade de cada componente na fase móvel.
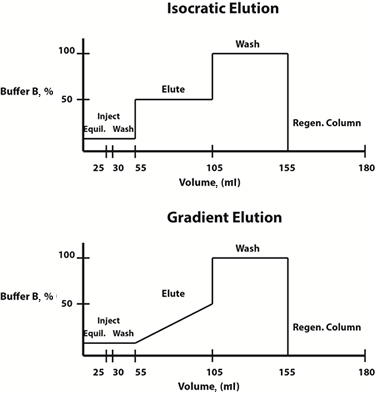
Fig. 3: Exemplo de diagramas de composição de buffer para protocolos de eluição isocrática (superior) e gradiente (inferior).
as condições de eluição podem ser alteradas de forma gradiente linear ou de forma gradual. Muitas vezes, um protocolo de eluição de gradiente, no qual a composição da fase móvel muda linearmente ao longo do tempo, é escolhido para determinar o perfil de eluição e a concentração de tampão de eluição na qual a proteína de interesse é liberada da resina. Uma vez determinada essa concentração, para economizar tempo, um protocolo de eluição isocrática gradual, no qual a composição da fase móvel é constante a cada etapa, pode ser projetado para futuras purificações.
Nota: A cromatografia de exclusão de tamanho não requer alterações de buffer, pois não depende de interações específicas entre a fase móvel e a fase estacionária. Não há etapas verdadeiras de lavagem e eluição, pois a SEC depende apenas do fato de que grandes moléculas são retardadas por contas porosas, enquanto pequenas moléculas passam pela resina com interação mínima de resina.
Lavagem da coluna Final
após a eluição da proteína de interesse da resina, quaisquer proteínas que permaneçam ligadas à resina são eluídas aumentando a resistência do tampão de eluição. Esta etapa permite que as colunas sejam reutilizadas para futuras separações.
regeneração da coluna
depois de retirar os compostos restantes ligados à mídia, a coluna é então saturada com buffer de equilíbrio para reutilização subsequente ou preenchida com um buffer de armazenamento.
Leave a Reply