culoarea indicatorului fenolftaleinei în soluția bazică este: (a) Galben(B) Verde(c) Roz (D) portocaliu
indiciu: fenolftaleina este un acid slab și astfel eliberează ioni ${H^ + }$ în soluție. Anionul se formează astfel colorat și indică punctul final. Adăugarea unei baze la fenolftaleină face ca echilibrul să se deplaseze spre mediul acid și să elibereze mai mulți ioni ${H^+}$.
soluție completă pas cu pas:
-fenolftaleina este un indicator sintetic cu o formulă moleculară de ${C_{20}}{H_{14}}{O_4}$. Acesta aparține clasei de coloranți ftaleină și este cel mai adesea folosit ca indicator în titrările acido-bazice. Prin natura sa, are o solubilitate foarte scăzută în apă și, prin urmare, pentru utilizare în experimente, este dizolvată în alcool.
structura sa este:
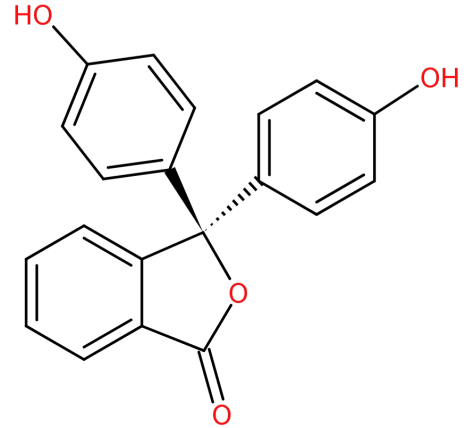
-se formează prin condensarea anhidridei ftalice cu doi echivalenți de fenol în condiții acide.
-este un acid slab și astfel are capacitatea de a pierde ioni ${H^ + }$ în soluție. Înainte de a pierde ionul ${H^+}$, molecula fenolftaleinei este incoloră, dar după pierderea ionului ${H^ + }$ formează ionul fenolftaleinei care este de culoare Roz.
conform principiului lui Le-Chatelier, dacă adăugăm o bază la fenolftaleină, echilibrul se va deplasa către mediul acid, ducând la eliberarea mai multor ioni ${H^+}$. Transformând astfel soluția din incoloră în roz.
prin urmare, putem spune că fenolftaleina rămâne incoloră în soluțiile acide și neutre și devine roz în soluțiile bazice. Rămâne incolor până la pH-ul de 8.5, în timp ce deasupra se transformă în culoare roz până la roșu intens.
-în stare lichidă este incoloră, dar când se găsește în formă cristalină solidă, fenolftaleina este de culoare alb-gălbuie până la portocaliu pal sau pulbere cristalină albă fină.
-fenolftaleina este utilizată pe scară largă ca indicator de pH și agent de laborator. Este, de asemenea, utilizat în titrările acido-bazice ca indicator, medical ca laxativ și în testul Kastle-Mayer, de asemenea. Împreună cu roșu de metil, albastru de timol și albastru de bromotimol, poate acționa și ca o componentă a indicatorului universal.
deci, opțiunea corectă va fi: (C) roz.
notă: Poate adopta până la 4 stări diferite în soluții apoase datorită modificărilor pH-ului. Când condițiile sunt puternic acide, există în forma protonată ($H {\ln^+}$), care are o culoare portocalie. Atunci când condițiile sunt între puternic acide și ușor bazice, există sub formă de lactonă (Hln), care este incoloră. În condiții de bază există sub formă de fenolat dublu deprotonat (${\ln ^{2 -}}$) Care este incolor și în condiții puternic de bază formează $\Ln {(OH)^{3 – }}$ formă care este incoloră.
Leave a Reply