Vätskekromatografiprinciper
oavsett interaktioner som utnyttjas utförs vätskekromatografi i sex steg:
- Kolonnjämvikt
- provbelastning
- tvättning
- eluering
- slutlig kolonntvätt
- Kolonnregenerering
Kolonnjämvikt
de flesta vätskekromatografiprotokoll börjar med ett hartjämviktssteg. En buffert som är kompatibel med proteinet av intresse och det valda hartset passeras över kolonnen. En vanlig praxis är att jämvikta kolumnen med 5-10 kolumnvolymer (CVs) av jämviktsbuffert.
till exempel är bindning av proteiner till hydrofoba interaktionshartser mest effektiva vid hög jonstyrka. Före provansökan jämviktas hartset därför i en buffert med hög jonstyrka.
egenskaperna hos proteinet av intresse beaktas också vid val av jämviktsbuffert, eftersom buffertfaktorer såsom jonstyrka begränsas av proteinstabilitet; vanligtvis skulle man undvika jämviktsbuffertbetingelser som skulle denaturera proteinet av intresse eller förhindra att det interagerar med den stationära fasen.
provbelastning
efter jämvikt laddas provet på kolumnen. Provet laddas i allmänhet i en buffert med samma sammansättning som jämviktsbufferten för att maximera proteininteraktionen med den stationära fasen.
provet kan laddas manuellt eller med en provpump. Vissa typer av kromatografi begränsar volymen av prov som kan laddas på kolonnen. Ett annat viktigt provbelastningsövervägande är att de flesta hartser har en begränsad kapacitet att binda protein; överbelastning av en kolonn genom att applicera för mycket prov kan påverka separationen negativt.
Kolonntvätt
när proteiner har immobiliserats i den stationära fasen avlägsnas proteiner som endast interagerar svagt eller icke-specifikt med hartset genom att tvätta kolonnen med flera kolonnvolymer tvättbuffert. Denna tvättbuffert kan ha samma sammansättning som jämviktsbufferten eller innehålla komponenter som stör svaga specifika interaktioner.
till exempel, immobiliserad-metall affinitetskromatografi (IMAC) eluerar proteiner bundna till hartset med en hög koncentration av immidazol. En vanlig praxis är att använda en tvättbuffert som innehåller en mellanliggande koncentration av immidazol för att eliminera förorenande proteiner som endast är svagt bundna till hartset.
kolonnen tvättas tills inget protein detekteras i eluatet. Vid användning av ett kromatografisystem med UV-detektor tvättas kolonnen tills 280 nm absorptionsavläsningen återgår till baslinjen.
prov eluering
när alla icke-specifika och svagt interagerande proteiner har tvättats bort från hartset elueras proteiner som interagerar starkt med hartset från kolonnen genom att ändra sammansättningen av bufferten som passeras över hartset.
i jonbyteskromatografi elueras proteiner med buffertar med hög jonstyrka eller med en förändring i pH för att störa de elektrostatiska interaktioner som immobiliserade proteinet av intresse. Proteiner bundna till ett hydrofobt interaktionsharts, omvänt, elueras genom att sänka buffertens jonstyrka. I affinitetskromatografi elueras proteiner vanligtvis från kolonnen genom införandet av en konkurrerande ligand eller genom att klyva affinitetstaggen och kan också elueras med hjälp av högsaltbuffertar eller förändra pH. Andra elueringsprotokoll kan innebära blandning av lösningsmedel med varierande polaritet för att ställa in lösligheten för varje komponent i mobilfasen.
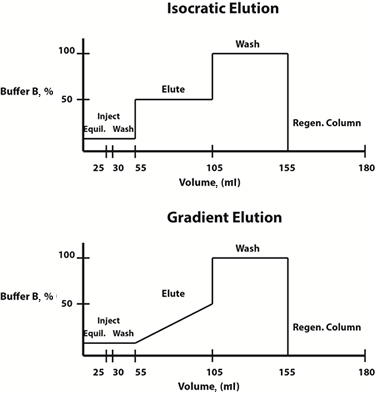
Fig. 3: Exempel buffertsammansättningsdiagram för isokratiska (topp) och gradient (botten) elueringsprotokoll.
Elueringsförhållanden kan antingen ändras på ett linjärt gradient sätt eller stegvis. Ofta väljs ett gradient elueringsprotokoll, i vilket sammansättningen av den mobila fasen förändras linjärt över tiden, för att bestämma elueringsprofilen och elueringsbuffertkoncentrationen vid vilken proteinet av intresse frigörs från hartset. När denna koncentration har bestämts, för att spara tid, kan ett stegvis isokratiskt elueringsprotokoll, där sammansättningen av mobilfasen är konstant vid varje steg, utformas för framtida reningar.
notera: Storlek uteslutning kromatografi kräver inte buffertförändringar eftersom det inte beror på specifika interaktioner mellan den mobila fasen och den stationära fasen. Det finns inga sanna tvätt-och elueringssteg, eftersom SEC enbart bygger på det faktum att stora molekyler fördröjs av porösa pärlor, medan små molekyler passerar genom hartset med minimal hartsinteraktion.
Slutkolumntvätt
efter att proteinet av intresse har eluerats från hartset elueras alla proteiner som förblir bundna till hartset genom att öka styrkan hos elueringsbufferten. Detta steg tillåter kolumner som ska återanvändas för framtida separationer.
Kolonnregenerering
efter avlägsnande av de återstående föreningarna bundna till mediet mättas kolonnen antingen med jämviktsbuffert för efterföljande återanvändning eller fylls med en lagringsbuffert.
Leave a Reply